Que es el pH?
El pH es una fórmula logarítmica negativa que nos dice la concentración de iones de hidrógeno por unidad de volumen
Es muy útil debido a que es un indicador que nos dice que tan ácida o que tan alcalina es una sustancia. El agua neutra tiene un pH de 7.0 y este factor se deriva de la siguiente manera:
La molécula del agua se disocia naturalmente en concentraciones muy pequeñas de iones de hidrógeno y iones de hidróxido.
H2O ⇌ (H+) + (OH−)
En un litro (lt) de agua existen 1x10 ^ (-7) iones de hidrógeno y la misma cantidad de iones de hidróxido, es decir un balance del 50-50. Cuando introducimos esto en la fórmula del pH:
pH = -log[H+] = -log [ 1x10 ^ (-7)] = 7
A partir de esa derivación, podemos obtener el pH de diferentes sustancias y reconocer su acidez y así saber el impacto que tendrán al agregarse en un cuerpo de agua, ademas de poder calcular dosis.
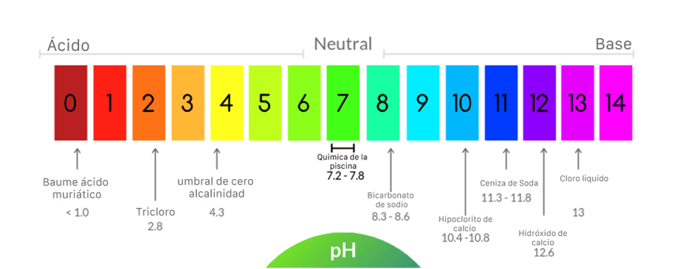
Todo lo que agregamos a la piscina tiene un pH diferente a 7 y es también importante recordar que es una fórmula logarítmica, lo que significa que los números enteros tienen diferencia de 10x en cuestión de acidez. Por ejemplo el tricloro con un pH de 2.8 es aproximadamente 10,000 veces más acido que el agua con pH de 7.0 (7-3 =4 lo que implica 10x10x10x10).
¿Cómo afecta el pH a la química del agua?
Básicamente, todo en la química de la piscina se ve afectado por el pH de una forma u otra. El pH influye en el equilibrio del índice de saturación de langelier, en los equilibrios de las diferentes especies de alcalinidad y también de boratos e inclusive en la fuerza del cloro. Observemos la siguiente gráfica:
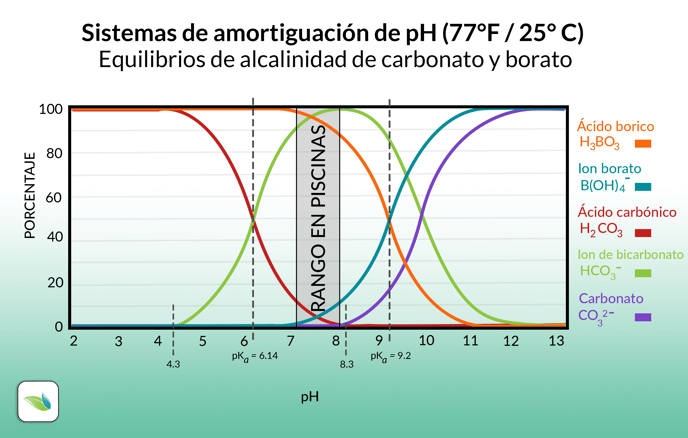
El pH y el porcentaje de cada una de las especies son dependientes el uno del otro. En el rango de la química de las piscinas podemos observar como la mayoría de los iones de alcalinidad son de bicarbonato y la mayoría del sistema de boratos es acido borico.
Por qué es importante el pH, según los libros de texto de la industria de piscinas
En nuestra industria la importancia del pH es bastante reconocida y citan tres razones principales por cuales tenemos que mantener una química entre 7.2 y 7.8
- El pH controla la fuerza del cloro (%HOCl)
- El pH afecta la comodidad del usuario
- El pH determina qué tan corrosiva es el agua o si depositara sarro (carbonato de calcio).
Cubramos estos 3 puntos rápidamente.
1. El pH controla la fuerza del cloro (%HOCl)
Esto es únicamente cierto cuando no existe ácido isocianúrico en el agua. El gráfico que se muestra abajo en el lado izquierdo es una representación de lo que se enseña en los libros de texto y muestra que un pH más bajo significa un cloro más fuerte, debido a un porcentaje más alto de la parte fuerte del cloro, el acido hipocloroso (HOCl).
Cuando se agrega cloro al agua (en cualquier forma), eventualmente se produce una disociación y se crean el ácido hipocloroso (HOCl) y su contraparte mucho más débil y lenta, el ion de hipoclorito (OCl-). Estas dos sustancias están en equilibrio entre sí y son totalmente dependientes del pH. Observe que la única diferencia entre sí es la separación con el hidrógeno.
HOCl ⇌ (H+) + (OCl-)
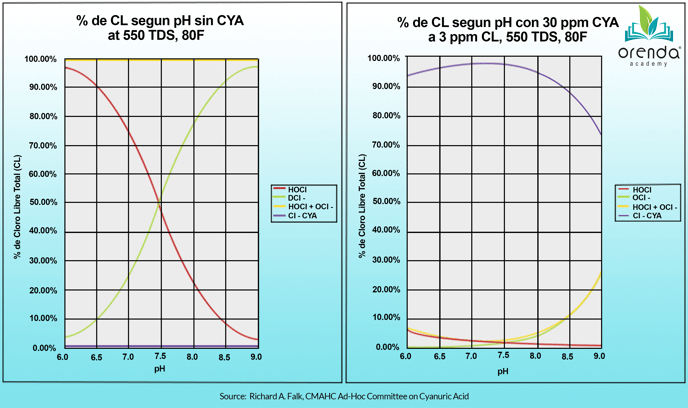
Pero nuevamente, el gráfico en la izquierda solo aplica cuando no se tiene CYA en el agua. El gráfico en la derecha representa el equilibrio una vez que introducimos CYA en la ecuación.
¿Dónde está la línea roja en el gráfico de la derecha? Verá que el % de HOCl está por debajo del 3% y muestra muy poca diferencia entre 7.0 y 8.5 de pH. Esto se debe a que el cloro unido al CYA no depende tanto del pH. Es una química totalmente diferente. Puede leer mas al respecto aquí.
2. El pH afecta la comodidad del usuario
No estamos de acuerdo. El pH del ojo humano fluctúa durante el día en una ventana desde 7.0 a 8.0. También el agua embotellada que consumimos es ofrecida con diferentes pH, desde 5 hasta 9+ e incluso el pH de la cerveza varía entre 4 y 4.6, y es la misma situación con muchos de los alimentos que consumimos a diario.
Hemos descubierto que la inconformidad del usuario, la irritación de la piel y los ojos se deben a altos niveles de cloro combinado que superan las 0.2 ppm.
3. El pH determina si el agua está sobresaturada o es corrosiva
Bueno en parte si...pero solo porque contribuye de manera significativa al equilibrio del índice de saturación de langelier. Es el ISL el que dicta el equilibrio total y de hecho toma en cuenta 6 factores, no solo el pH. Esto significa que el pH puede estar dentro de los valores recomendados y aun así se puede tener agua agresiva. Equilibrar el ISL y manejar el calcio adecuadamente es nuestro primer pilar del cuidado proactivo de piscina.
CO2 y pH
La cantidad de CO2 disuelto en el agua afecta el pH y, de muchas maneras, determina el pH. Esto se debe al equilibrio de la alcalinidad de carbonato, pero esa es una conversación para otro artículo. Obtenga más información sobre la alcalinidad de los carbonatos aquí.
Cuanto más CO2 esté disuelto en el aguah, menor es el pH (y viceversa):
↑CO2 = ↓pH
↓CO2 = ↑pH
La aireación eleva el pH porque el CO2 se escapa del agua. Las algas también elevan el pH porque consumen CO2 y lo eliminan de la solución.
Más CO2 reducirá el pH, razón por la cual muchas piscinas comerciales inyectan CO2 para controlar el pH en lugar de utilizar ácido. El ácido reduce el pH al convertir la alcalinidad del bicarbonato en ácido carbónico (H2CO3). El ácido carbónico es simplemente CO2 disuelto en agua (H2O + CO2 ⇌ H2CO3).
El pH se puede suprimir mediante la alimentación de ácido, al usar pastillas de tricloro o al tener una cubierta automática sólida, que previene, o al menos ralentiza, la pérdida natural de CO2.
Ley de Henry y la liberación natural del CO2
En términos simples, la ley de Henry establece que cualquier gas disuelto en un líquido debe estar en equilibrio con ese mismo gas sobre el ambiente. Una bebida carbonatada (como un refresco o una cerveza) no tiene burbujas hasta que se abre la botella. Luego, al destaparse y exponerse el ambiente, las burbujas saturadas de la bebida comienzan a escaparse hasta que se llega al equilibrio, esto pasa cuando la bebida pierde todo su gas. Esta es la Ley de Henry en acción.
La misma física se aplica en las piscinas. Al igual que un refresco o una cerveza, eventualmente el CO2 se igualará con el aire sobre el agua y la piscina perderá su gas, aunque nunca vemos las burbujas porque el área de la superficie es mucho mayor y el porcentaje de CO2 es mucho menor.
Esta liberación natural de CO2 es lo que causa que el pH suba. Ese punto exacto de equilibrio de CO2 es cuando el pH llega al "pH(eq)", que en Orenda bautizamos como el techo del pH. Nos dice exactamente qué tan alto puede subir naturalmente el pH. El siguiente gráfico muestra el techo del pH en relación con la temperatura y la alcalinidad de carbonato.
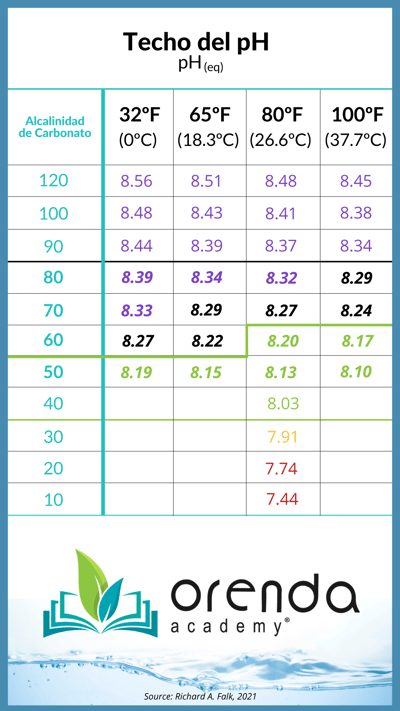 El pH no puede subir naturalmente por encima de su techo. Pero puede ser forzado si la piscina tiene una sobredosis de ácido o carbonato de sodio.
El pH no puede subir naturalmente por encima de su techo. Pero puede ser forzado si la piscina tiene una sobredosis de ácido o carbonato de sodio.
Esto nos permite predecir hacia dónde se dirige el pH y contener el pH en lugar de tratar de controlarlo. La aplicación Orenda ahora cuenta con la opción de mostrar lecturas secundarias, en donde se reflejan el techo del pH y la alcalinidad de carbonatos.
Consulte los enlaces a continuación para obtener más información.
Conclusión
El pH nos dice qué tan ácida o básica es una sustancia, y es de hecho una fórmula que nos dice la concentración de iones de hidrógeno. Cuanto más hidrógeno, más ácido. Cuanto menos hidrógeno en comparación con la concentración de iones de hidróxido, más alcalino (o básico).
Aquí hay algunos artículos relevantes si desea leer más:
- ¿Cuál es el pH ideal de una piscina?
- ¿Qué causa un pH alto en una piscina?
- pH, CO2 y Ley de Henry
- Conteniendo el pH en lugar de controlarlo el pH
- Alcalinidad total y el pH
